
On peut supposer que l'acidité des sodas ne permet pas de les mettre en contact direct avec le fer.
Qu' arriverait-il si on mettait une solution acide en contact avec le fer?
Regardez la vidéo de la manipulation.
Réaction entre le fer et l’acide chlorhydrique
Réaction acide-base
I. Qu’est-ce que l'acide chhlorhydrique?
C’est un liquide incolore obtenu en dissolvant dans de l’eau, un gaz appelé chlorure d’hydrogène.
On obtient ainsi une solution aqueuse de chlorure d’hydrogène que l’on appelle; acide chlorhydrique
Cette solution contient des molécules d’eau, des ions chlorure Cl -et des ions hydrogène H+.
a)Vérifions la présence majoritaire des ions hydrogène H+
Au papier pH, on évalue pH = 1 A l’aide du pH-métre, on mesure pH= 0,60
Le pH est faible, on est donc bien en présence d’une solution acide.
b) Vérifions la présence des ions chlorure Cl -

II. Mettons de l’acide chlorhydrique en présence de fer

1) Test sur le gaz
On bouche le tube à l’aide d'un bouchon et on laisse s'accumuler le gaz.
On retire le bouchon et on présente une flamme.

2) Identification des espèces présentes en fin de réaction
Fin de réaction
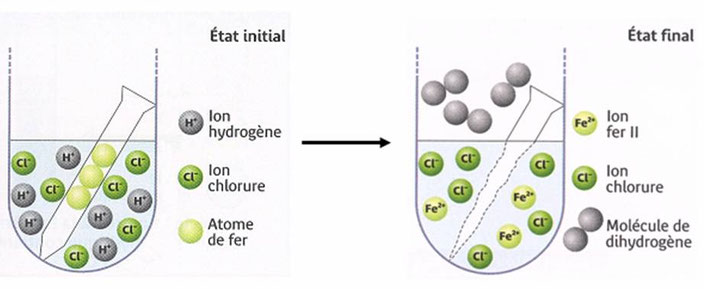
On constate qu’une partie du fer à disparu.
On filtre la solution obtenue. Le filtrat est verdâtre.
a) Mesure du pH de la solution finale
A l’aide du pH-métre, on mesure pH = 2
Donc l’acidité a diminué, c’est-à-dire que des ions hydrogène H+ ont disparu.
On réalise deux tests : On répartie le filtrat dans deux tubes à essais.
b) Test au nitrate d’argent
Il se forme un précipité blanc qui noircit à la lumière donc la solution finale contient toujours des ions chlorure.
Les ions chlorure n’ont pas réagi.
c) Test à la soude
Il se forme un précipité vert foncé donc la solution finale contient des ions fer II.
Pour résumer
Du fer et des ions hydrogène disparaissent. Il se forme du dihydrogène et des ions fer II
(les ions chlorure ne réagissent pas)
Bilan de cette transformation:

Équation de réaction
Le nombre d’atomes et de charges électriques doivent être conservés!!

Puisque les ions chlorure ne réagissent pas , on peut écrire plus simplement :

Le bilan par l’image
III. Réaction acide-base :
Avant de rejeter les produits industriels dans la nature, il faut les traiter chimiquement de façon à ramener leur pH à une valeur voisine de 7.
Expérience de neutralisation:
Avant de commencer on mesure le pH des solutions. Pour l'acide pH= 1 , pour la soude pH = 14.
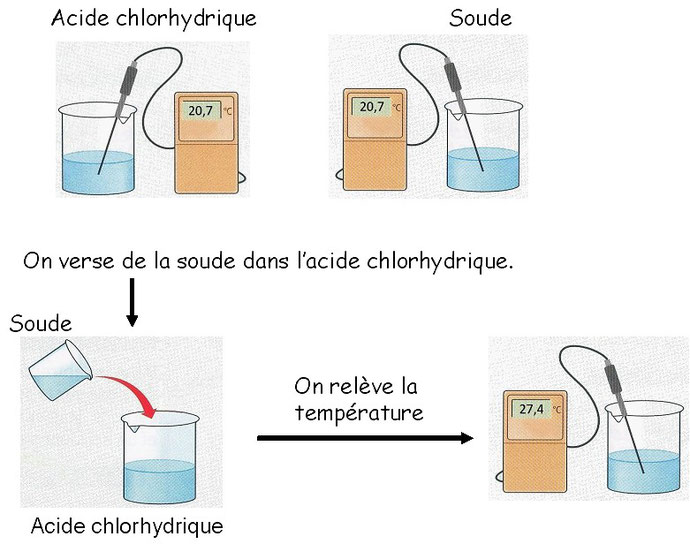
On constate que la température augmente et le pH est proche de 7.
L’équation de réaction est :

On obtient une solution aqueuse de chlorure de sodium, c'est de l’eau salée !
Ce site a été conçu avec Jimdo. Inscrivez-vous gratuitement sur https://fr.jimdo.com